タウアイソフォームを制御し持続性に優れた核酸医薬開発
研究の概要
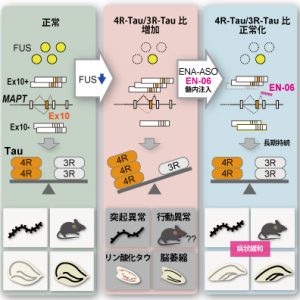
タウタンパク質は、選択的スプライシングによるアイソフォームが存在し、3リピートタウ(3R-tau)と4リピートタウ(4R-tau)に大別されます。ヒトでは両者がほぼ同量発現しますが、4リピートタウオパチー(進行性核上性麻痺(PSP)、大脳皮質基底核変性症(CBD))では、4R-tauの過剰蓄積が知られています。
研究のポイント
- 4リピートタウタンパク質が蓄積する神経変性疾患(FTLD、PSP、CBD)に対する有効な治療法は未確立。
- FTLDモデルマウスにASOを投与し、4R-tauと3R-tauの発現比率を抑制し、病理症状(行動異常、リン酸化タウ蓄積、海馬萎縮)の緩和を確認。
- 使用したASOは、2'-O,4'-C-ethylene-bridged nucleic acid(ENA)修飾により高い安定性と長期持続性を示す。
- 本研究の成果は、FTLDやPSPなどの4リピートタウオパチーの治療開発につながることが期待される。
研究の背景
タウタンパク質は、アルツハイマー病(AD)、FTLD、PSP、CBDなどのタウオパチーの原因とされています。これらの疾患はリン酸化タウの蓄積を特徴とし、特にFTLD、PSP、CBDでは4R-tauの蓄積が確認されています。
現在、タウオパチーの治療法として、タウの発現、リン酸化、凝集を標的とした免疫療法や化合物の開発が進められていますが、多くは臨床試験段階に至っていません。
研究グループは、FTLDやPSPなどの4リピートタウオパチーにおいて、RNA結合タンパク質(FUS、SFPQ)の異常がタウアイソフォームのバランス異常を引き起こすことを発見しました。
本研究の方法と成果
MAPTエクソン10スプライシング調節のためのENA-ASOの設計
MAPT遺伝子のエクソン10および隣接イントロンを標的としたENA-ASOを複数選定し、効果が高いものをin vivo解析用に選定しました。
FTLDモデルマウスへのEN-06投与の効果
- エクソン10スキッピングを92%誘導。
- 4R-tau/3R-tau比を抑制し、行動異常、シナプス異常、神経変性の改善を確認。
- 最適用量は50 µgと判明。
薬物動態と安全性の評価
- 脳全体に広がる分布と神経細胞への強い局在シグナルを確認。
- 急性毒性なし、肝・腎毒性も認められず、安全性が確認された。
- 既存のMOE修飾ASOと比較し、半減期が2倍(約6ヶ月)、効果持続が2年と長期安定性を示した。
今後の展望
本研究により、EN-06が4リピートタウオパチーの症状を改善し、長期間の効果と安全性を示すことが確認されました。
今後は、高用量の非臨床試験を実施し、安全性と有効性のさらなる検証を進め、初めてのヒト臨床試験へ向けた準備を進めます。
本研究成果は、2025年3月6日付(日本時間3月7日)米国遺伝子細胞治療学会の学術雑誌『Molecular Therapy Nucleic Acids』に掲載されました。